Лечение коронавирусных инфекций представляет собой довольно сложную клиническую задачу. Известно, что в процессе биологической эволюции природа наградила организм человека великолепным механизмом противостояния вирусным атакам, который реализован в системе цитокиновых белков – интерферонов (ИФН).

История интерфероновых полипептидов началась более 60 лет назад, когда Алик Айзекс и Жан Линдеман открыли явление вирусной интерференции: зараженные вирусами клетки производили белок, который ингибировал рост этих вирусов. Интерферон обеспечивают как врожденную, так и системную реакции организма в ответ на вирусную атаку [1].
Интерфероны I типа (интерферон-α, интерферон-β) обеспечивают экспрессию интерферон-стимулированных генов (ISG), стимулируют антигенпрезентирующие функции макрофагов, увеличивают синтез цитокинов, усиливают активность натуральных киллеров (NK-клеток) и дендритных клеток. Посредством протеинкиназы накапливается олигоаденилатсинтетаза, приводящая к образованию 2,5-олигоадениловой кислоты – она активирует клеточную эндонуклеазу, которая разрушает молекулы вирусной РНК.
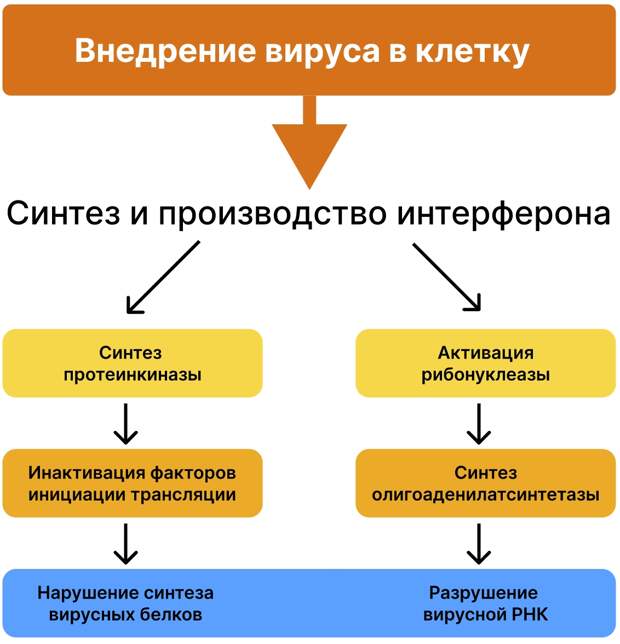

В 1981 году S.Levin с соавторами впервые выявили врожденные и приобретенные нарушения в системе интерфероновой защиты, связанные с низким уровнем синтеза эндогенного интерферона. Французские исследователи C. Le Page с соавторами доказали, что острая вирусная инфекция характеризуется повышенным уровнем интерферона, более 70% клеток организма находится в статусе антивирусного режима, но при тяжелых формах вирусных заболеваний интерфероновая система организма испытывает функциональную депрессию и интерфероновый дефицит. Депо интерферона в организме отсутствует. В. В. Малиновская с соавторами (2005) уточнили, что острая вирусная инфекция также приводит к транзиторной иммуносупрессии и истощению интерферонового пула в организме [4,5,6].
В процессе эволюции коронавирусы, как и другие вирусы, выработали молекулярно-биологический механизм ингибирования интерферона в клетках. Белок вируса гриппа NS1 может блокировать экспрессию генов интерферона I и III типов, а белок PA-X подавляет экспрессию генов клеточного иммунного ответа: он ингибирует синтез протеинкиназы R – важного фактора противовирусной защиты. За синтез этого фермента и отвечают интерфероны I и III типов [7,8].
Новый коронавирус SARS-CoV-2 на начальном этапе заражения также блокирует синтез интерферона посредством белка ORF9b [9, 10]. Кроме того, у коронавирусов имеется фермент эндорибонуклеаза, с помощью которого они подавляют раннюю активацию интерферона как в эпителиальных клетках, так и в макрофагах. S-белок вируса связывается с лектинами иммунных клеток, подавляет функцию макрофагов и Т-лимфоцитов [11,12,13].
Таким образом, механизм блокировки коронавирусами синтеза эндогенного интерферона, поражение вирусом SARS-CoV-2 как эпителиальных клеток, так и макрофагов, отсутствие депо интерферона – являются достаточным основанием для введения в организм экзогенного интерферона в качестве средства профилактики и терапии ОРВИ и COVID-19. Интерфероны (IFN) продемонстрировали клиническую эффективность при лечении различных вирусных инфекций и широко используются для лечения пациентов с COVID-19 [14,15,16]
На сегодняшний день на фармацевтическом рынке представлено много лекарственных препаратов – как нативного рекомбинантного интерферона, так и его индукторов. Наиболее популярными у клиницистов являются препараты рекомбинантного интерферона – α-2b с антиоксидантами (токоферола ацетат – витамин Е и аскорбиновая кислота – витамин С), выпускаемый в лекарственных формах гель, мазь, ректальные суппозитории [17,18,19].
Антиоксиданты успешно борются с окислительным стрессом, разрушают молекулы свободных радикалов за счет передачи им свободных электронов, в связи с чем свободные радикалы лишаются своих агрессивных окислительных свойств.

Аскорбиновая кислота (витамин С) выполняет биологические функции восстановителя и кофермента некоторых метаболических процессов; обладает выраженными антиоксидантными свойствами. Токоферола ацетат (витамин Е) относится к группе жирорастворимых веществ. Его основная функция — нейтрализация свободных радикалов, вызывающих повреждение клеток и тканей человека. Кроме того, токоферол – прекрасный химический проводник. Благодаря малому размеру молекулы и липофильности он легко преодолевает трансэпидермальные барьеры и может помогать проникать в организм другим активным веществам, например, интерферону.
Антиоксиданты повышают противовирусную активность рекомбинантного человеческого интерферона α-2b в 10–14 раз, что позволяет получить высокий терапевтический эффект даже при минимальной дозе.
Однако применение малых доз экзогенного интерферона не всегда клинически оправдано, особенно при интраназальных лекарственных формах, которые в большинстве случаев содержат невысокую дозу – 3000 МЕ/мл.
При интраназальном введении водный раствор интерферона сталкивается с гидрофобной муцинозной слизью носовой полости. При этом образуются капли раствора, которые слабо взаимодействую с несмачиваемой поверхностью муцинозной слизи, и под действием силы тяжести при вертикальном положении пациента, эти капли скатываются за пределы носовой полости.
Применение лекарственной формы интерферона в виде геля позволяет дозированно вводить препарат, преодолевая гидрофобную слизь полости носа, при этом, согласно проведенным исследованиям, действующее вещество из геля выделяется равномерно в течение 5 часов [20].
Лекарственная форма интерферона в виде ректальных суппозиториев позволяет ввести действующее вещество непосредственно в системный кровоток, минуя ферментативную функцию печени, поскольку липофильные неионизированные молекулы свободно проникают через слизисто-эпителиальный барьер ампулы прямой непосредственно к лимфатическим и кровеносным сосудам, далее – в большой круг кровообращения.

Биодоступность препаратов в лекарственной форме «ректальные суппозитории» в объеме 80% наступает на 20 минуте и сопоставима с инъекционными формами.
Результаты исследований свидетельствуют, что совместное применение ректальных и топических форм интерферона α-2b (свечи + гель) позволяет получать положительные результаты, которые можно видеть при оценке клинической эффективности лечения ОРВИ:
- Сокращается продолжительность лихорадочного периода, интоксикационного синдрома и астенизации,
- снижается число бактериальных осложнений,
- ускоряется достижение клинической ремиссии.
Положительные клинические эффекты, как правило, сопровождаются позитивной динамикой со стороны показателей иммунной системы.
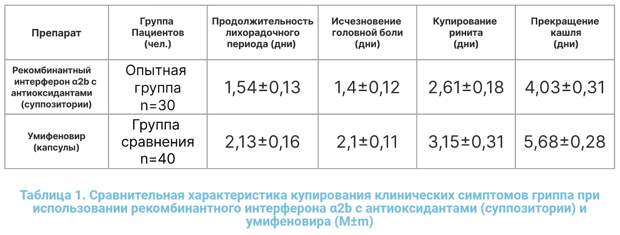
Снижение температуры к концу первых суток у пациентов, принимавших рекомбинантный интерферон α-2b с антиоксидантами (суппозитории) и «Умифеновир» – (капсулы) (в %).
Комбинация ректальной и топической форм интерферона α-2b (свечи + гель) обеспечивает положительную клиническую динамику и является эффективной и безопасной терапией для больных ОРВИ и гриппом [21,22].
На сегодняшний день предложено несколько принципиальных схем лечения COVID-19 с помощью рекомбинантного интерферона α-2b. Так, китайские авторы предлагают для различных возрастных групп дозировки от 1 200 000 МЕ до 10 000 000 МЕ/сутки. Меньшие дозы будут недостаточны для подавления развития вирусной инфекции, а лишь затормозят распространение вируса в организме [23].
Российские исследователями также проводятся научные исследования по разработке методик с применением высоких доз рекомбинантного интерферона α-2b с антиоксидантами в дозе от 1 млн МЕ до 3 млн МЕ 2 раза в сутки в виде ректальных суппозиториев, с параллельным введением геля в дозе 4000 МЕ 5 раз в сутки.
Таким образом, из представленных данных можно сделать вывод о том, что рекомбинантный интерферона α-2b с антиоксидантами обладает доказанной противовирусной активностью в отношении ОРВИ и новой коронавирусной Инфекции COVID-19.
ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ. НЕОБХОДИМА КОНСУЛЬТАЦИЯ СПЕЦИАЛИСТА
СПИСОК ЛИТЕРАТУРЫ
- Калюжин О.В. Острые респираторные вирусные Инфекции: современные вызовы, противовирусный ответ, иммунопрофилактика и иммунотерапия. М.: МИА, 2014
- Mordstein M., Neugebauer E., Ditt V. et al. Lambda interferon renders epithelial cells of the respiratory and gastro-intestinal tracts resistant to viral infections // J. Virol. 2010. 84. № 11. P. 5670–5677.
- Тотолян А.А., Фрейдлин И.С. Клетки иммунной системы. СПб.: Наука, 2000).
- Levin S., Hahn T. Evaluation of the human interferon system in vi-ral disease // Clin. Exp. Immunol. 1981. Vol. 46. № 3. P. 475–483.).
- Le Page C., Génin P., Baines M.G., Hiscott J. Interferon activation and innate immunity // Rev. Immunogenet. 2000. Vol. 2. № 3. P. 374–386.
- Малиновская В.В., Деленян Н.В., Ариненко Р.Ю., Мешкова Е.Н. Виферон. Комплексный противовирусный и иммуномодулирующий препарат для детей и взрослых. // Руководство для врачей. М.: ИНКО-ТНК, 2005).
- Калюжин О.В., Понежева Ж.Б., Семенова И.В. и др. Субпопуляции лимфоцитов, уровень интерферонов и экспрессия их рецепторов у больных хроническими гепатитами B и C: зависимость от вида вирусов и степени фиброза // Терапевтический архив. 2017. Т. 89. № 11. С. 14–20
- García-Sastre A. Induction and evasion of type I interferon responses by influenza viruses // Virus Res. 2011. 162. № 1–2. P. 12–18 ).
- Channappanavar R., Fehr A.R., Vijay R. et al. Dysregulated Type I Interferon and Inflammatory Monocyte-Macrophage Responses Cause Lethal Pneumonia in SARS-CoV-Infected Mice // J. Immunol. May 1, 2016, 196 (1 Supplement) 63.10)
- Yoriyuki Konno, et al. // SARS-CoV-2 ORF3b is a potent interferon antagonist whose activity is further increased by a naturally occurring elongation variant. // BioRxiv, May 12, 2020; doi: 10.1101/2020.05.11.088179
- Deng X., Aaron Vol A., , Yafang Chen Y., , Kristina KeselyR.R., Matthew Hackbart M., , Robert C. Mettelman R.C., et al Coronavirus Interferon Antagonists Differentially Modulate the Host Response during Replication in Macrophages// https://www.biorxiv.org/content/10.1101/782409v1.full Posted September 25, 2019).
- Chen C., Zhou Y., Wang D.W. SARS-CoV-2: a potential noveletiology of fulminant myocarditis.// 2020;10.1007/s00059-020-04909-z. doi:10.1007/s00059-020-04909-z
- Fabrizio Chiodo et al. // Novel ACE2-independent carbohydrate-binding of SARS-CoV-2 spike protein to host lectins and lung microbiota. // BioRxiv, May 14, 2020; DOI: 10.1101/2020.05.13.092478 )
- Fan-Ngai I, Lung K-Ch., Yuk_Keung Tso E. et al.Triple combination of interferon beta-1b, lopinavir–ritonavir, and ribavirin in the treatment of patients admitted to hospital with COVID-19: an open-label, randomised, phase 2 trial//The Lancet, 2020, DOI:https://doi.org/10.1016/S0140-6736(20)31042-4
- Xie Х., Yuanliang Jiang Y., Yuan Zeng Y., Liu H. Combination antiviral therapy with lopinavir/ritonavir, arbidol and interferon-α1b for COVID-19 //Int.Med.Press, 2020, doi: 10.3851/IMP3362
- Yan Zuo et al. Lopinavir/ritonavir and interferon combination therapy may help shorten the duration of viral shedding in patients with COVID‐19: A retrospective study in two designated hospitals in Anhui, China //Journal of Medical Virol., 2020, https://doi.org/10.1002/jmv.26127
- Понежева Ж.Б., Купченко А.Н., Понежева Л.О. и др. Клинико-иммунологическая эффективность комбинации ректальной и интраназальной форм рекомбинантного интерферона альфа-2b в терапии острых респи¬раторных вирусных инфекций // РМЖ. Медицинское обозрение. 2018. № 8 (II). С. 62–66.
- Рафальский В.В. Клиническое применение препаратов интерферона. — Смоленск, 2002. — 245 с.
- Суровенко Т.Н., Присеко Л.Г. Применение препаратов интерферона и его индукторов в амбулаторной педиатрической практике // Pacific Medical Journal, 2018, №. 4, С. 79–83
- Гладкая Ю.В., , Лосенкова С.О. Биофармацевтическое исследование степени высвобождения 2этил-6 метил-3гидроксипиридина сукцината из интраназального геля методом диализа //Вестник Смоленской медицинской академии, 2018, Т.14, №4, С.165-170
- Малиновская В.В., Чеботарева Т.А., Парфенов В.В. Клиническая эффективность применения препарата Виферон при лечении гриппа и ОРВИ у взрослых // Альманах клинической медицины. 2014. № 35. С. 109–115
- Малиновская В.В., Коржов И.В., Мосягин И.Г. Актуальные аспекты противовирусной терапии ОРВИ и гриппа в воинских коллективах // Морская медицина. 2020. Т. 6, № 1. С. 15–00, http://dx.doi.org/10.22328/2413-5747-2019-5-4-15-23.
Zhi Min Chen1, Jun Fen Fu1, Qiang Shu, Ying Hu Chen1 et.al. Diagnosis and treatment recommendations for pediatric respiratory infection caused by the 2019 novel coronavirus // World Journal of Pediatrics (2020) 16:240–246 https://doi.org/10.1007/s12519-020-00345-5
Реклама
ОБЩЕСТВО С ОГРАНИЧЕННОЙ ОТВЕТСТВЕННОСТЬЮ "ФЕРОН"
ИНН 7704322416
125424, ГОРОД МОСКВА, ВОЛОКОЛАМСКОЕ ШОССЕ, ДОМ 73, ЭТ 6 П 1 К 46 ОФ 602, ОГРН: 1027739647220